2023年夏から秋にかけて、SaMDに関する制度設計に向けていくつもの動きがみられています。5月に「プログラム医療機器の特性を踏まえた適切かつ迅速な承認及び開発のためのガイダンス」(以下、SaMD開発ガイダンス)(1)が公表され、9月にはDASH for SaMD2(2)が示されました。また、令和6年診療報酬改訂の議論の中で、診療報酬におけるSaMDの扱いについても議論が進められています。
今回の記事では、5月に公表されたSaMD開発ガイダンスとそのガイダンスの内容を踏まえて、新たに11月16日に発出された「プログラム医療機器の特性を踏まえた二段階承認に係る取扱いについて(医薬機審発 1116 第2号)」(以下、SaMD版リバランス通知)(3)について取り上げます。
これまでの経緯
以前の記事でも取り上げてきている通り、これらの制度動向の背景としては、SaMDの特性(頻回なアップデートが必要になること、開発期間と比較し技術進化を含めた外部環境変化が早いことなど)を踏まえ、より迅速な社会実装が可能となるような承認制度設計が必要であるという要望の声が一部開発者から上がったためです。
2020年の規制改革推進会議でSaMDが議題として取り上げられたことををきっかけ(4、5)に、DASH for SaMD(プログラム医療機器実用化促進パッケージ戦略)(6)が公表され、2021年からは行政と業界団体で議論が進められてきました。議論開始当時に悩ましい問題として上がったことは、従来、医療機器の業界要望をまとめてきていた業界団体(医機連など)には比較的新しいタイプのSaMD(AI based SaMDやDTx)の開発に着手しているベンチャー企業や製薬企業が所属していなかったということがあります。そこで、医機連が中心となり、医療ベンチャー協会やAI医療機器協議会、JaDHAといった新しい業界団体も議論に参加しながら要望のまとめなどが行われてきました。
要望のまとめの中で、SaMDの開発環境を整備していく上で主となる要望は、①SaMDの特性に合わせた承認制度のあり方、②SaMDの診療報酬上の評価のあり方の2つでした(※細かな要望は他にもある)。しかしながら、そもそも、SaMD開発に新規参入する企業は医療機器の各種制度のあり方について十分な知見がなく、またそれらの企業が頼る支援先もわかりづらいという課題が前提にあるという指摘もありました。
そこで、①のSaMDの特性に合わせた承認制度のあり方に関する議論の中で、2022年に厚生労働省の事業として立ち上がった「プログラム医療機器の特性を踏まえた薬事承認制度の運用改善検討事業」(研究代表者:中野壮陛氏/公益財団法人医療機器センター)において、開発の道標となるSaMD開発ガイダンスが作成されることとなりました。
SaMD開発ガイダンスの中身
業界団体から求められた「SaMDの特性に合わせた承認制度のあり方」議論の中で、SaMDの特性、つまり従来の医療機器よりも短いサイクルで性能を含めた設計変更が承認前・市販後に生じうるといった性質などから、段階的な承認を求める声(これは以前の記事(7)でもご紹介したので割愛)がありましたが、そもそも医療機器の薬事承認を目指す上で必ずしも段階的な承認をしなければならない製品ばかりではありません。
そこで、SaMD開発ガイダンスは、SaMDに関する基本知識、既存の利活用可能な制度の整理、および既存の制度では対応できないタイプのSaMDに求められる二段階承認の考え方という形で構成されています。詳細についてはSaMD開発ガイダンスをご確認いただければと思いますが、以下に簡単に各章の説明を記載します。
プログラム医療機器の適切かつ迅速な承認及び開発に関する一体的考え方
この項では、SaMDの開発における基本的な考え方が示されています。SaMDは医療機器として開発する必要があるため、そもそも医療機器の開発において求められることが簡潔に記載されています。
概念的要求事項、開発コンセプト、臨床的位置付け、など医療機器の開発に携わってきた人であれば聞いたことのあるものですが、なかなか医療機器の業界外からSaMD開発に参入した人にとっては馴染みの薄い用語と定義であり、基礎的な内容から説明がなされていることは、有意義なものかと思われます。
また審査上の論点についても記載されており、臨床評価を含めどのような性能評価が必要なのかについても製品のタイプによって記載されているだけではなく、リスクマネジメントやソフトウェアライフサイクルプロセス、セキュリティなど、SaMDが医療機器として求められる評価についても言及されています。
現時点において利活用可能な薬事承認制度
この項では、これまでに医療機器の薬事承認制度として実施されているものについて個別に解説されています。
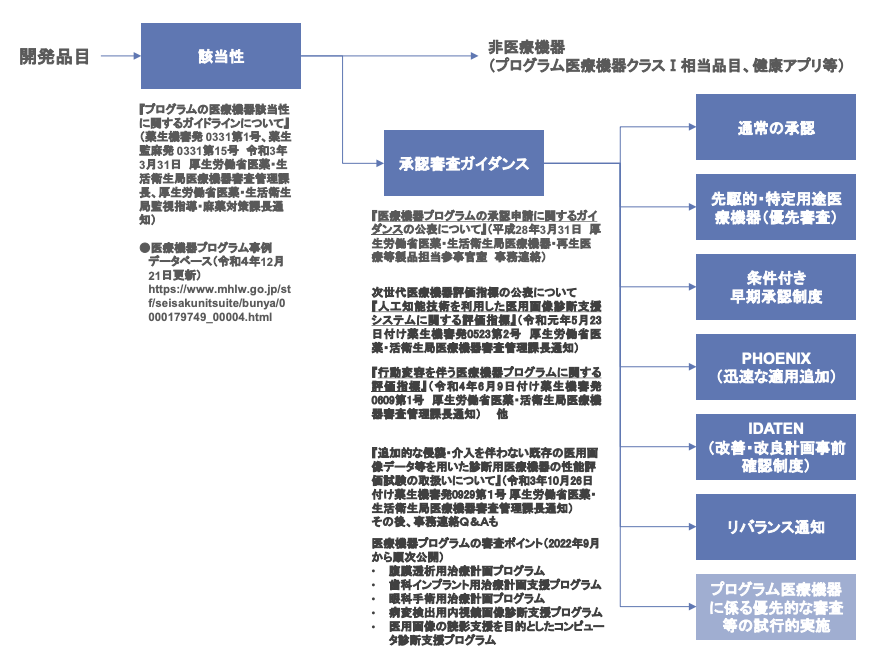
(SaMD開発ガイダンスp17 図3より)
上の図の通り、医療機器の薬事承認制度は通常の承認以外にもいくつかあり、これらの制度がSaMDを対象にしていないというわけではありません。この中でも、リバランス通知は「医療機器の「臨床試験の試験成績に関する資料」の提出が必要な範囲等に係る取扱い(市販前・市販後を通じた取組みを踏まえた対応)について」という通知の略称ですが、医療機器を段階的に上市できる制度として2017年に開始されているものです。
リバランス通知の活用ケースはいくつかありますが、下図のように開発初期には臨床的意義が確立していないパラメータを示せる範囲のデータで限定的な目的などで承認(第一段階承認)し、市販後の臨床的エビデンスの蓄積により臨床的意義が確立した段階で二段階目の承認を得るという開発戦略などがあります。
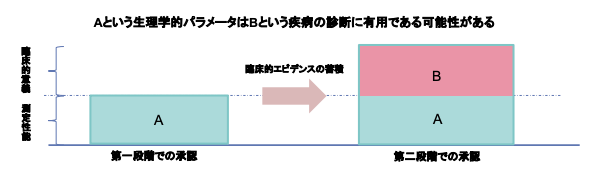
(SaMD開発ガイダンスp20 図4より)
更なる上市の加速に向けた新たな薬事承認制度の考え方
上記のリバランス通知がある中で、SaMDは安全性の問題が相対的に発生しにくいとされていることや継続的な性能等に関する改良・改善が想定される等の特性を踏まえて情報提供のあり方を検討することが必要であることから、この項では、従来のリバランス通知の考え方を参考にしつつも、SaMDの特性を考慮した二段階承認の考え方を整理することが必要であり、疾病診断用SaMD、疾病治療用SaMDに項目立てて言及されています。
SaMD版リバランス通知について
SaMD開発ガイダンスでの現状及び論点の整理も踏まえて、11月16日に「プログラム医療機器の特性を踏まえた二段階承認に係る取扱いについて」という通知(以下、SaMD版リバランス通知)(3)が発出されました。この通知においても、SaMDガイダンスと同様、疾病診断用SaMDと疾病治療用SaMDに項別に考え方が示されています。(なお、疾病予防用SaMDについては、一次予防目的のものは医療機器に該当せず、二次/三次予防のものは疾病治療用に類するものとして評価できるとして記載が簡略されています。)
こちらについても、以下に一部記載しますが、詳細については通知をご確認ください。
疾病診断用SaMDに関する二段階承認の考え方
疾病診断用SaMDにおいては、以下がリバランス通知の対象となりうるSaMDとして例示されています。
- 生体信号に関わる生理学的指標に係る能動なモニタリング医療機器(生体物理現象検査用装置、生体電気現象検査用装置、生体現象監視用装置、画像診断装置等)等、非侵襲的な測定や撮影等を行う医療機器やスマートフォン等の携帯情報端末を含む汎用コンピュータ等のWebカメラ等の内部又は外部センサ、各種検査情報等から生理学的パラメータ等を算出するプログラム。
- 最終的に目標とする臨床的意義がまだ確立されていないものの、別途、疾病の診断の参考情報として、いくつかの判断基準の一つを提供するプログラム医療機器と位置づけられるもの。
- 誤った検査結果が得られた場合に、ヒトの生命及び健康に重大な影響を与えるおそれがあるものではないもの。
一方で、「臨床的により精緻な情報が期待される」ような製品は対象とならないものとして例示されています。
- 検査・診断結果が、がんの治療方針や救急医療における初期対応方針等のように医学的判断に大きく影響するもの
- 遺伝子関連検査のように日々新たな情報が提供される分野
- 肺結節やポリープ等、プログラム医療機器が提示する情報が臨床的意義や医学的判断基準が確立されている分野(既に類似の承認品目がある等)
- 申請品目と同様の使用目的又は効果の範囲である医療機器又はプログラム医療機器等が第2段階承認を取得し、臨床現場で使用されている場合
また、一段階目の承認後のエビデンス収集として、どのようなデータをどのように取得していくべきか(製造販売後臨床試験成績、レジストリを含めたリアルワールドデータなど)については、開発戦略にも関わることから事前にPMDAと相談することが求められています。
疾病治療用SaMDに関する二段階承認の考え方
疾病治療用SaMDについては、以下がリバランス通知の対象となりうるSaMDとして例示されています。
- 最終的に目標とする疾病の治療法としての臨床的意義が確立されていないものの、性能評価に関する試験成績に加えて、特定の症状緩和又は状態改善等が探索的治験成績等により示されているなど、一定の有効性が蓋然性をもって確認できるもの。
- プログラム医療機器が提示する情報に基づいて、医師による治療等を補助又は支援した場合でも、既存治療等の有効性及び安全性に影響を及ぼす懸念が想定されないもの。
また、「すでに同様の使用目的又は効果の範囲である医療機器又はプログラム医療機器が第2段階承認を取得し、臨床現場で使用されている場合にあっては、臨床的により精緻な情報が期待される」ことから、原則二段階承認ではなく通常承認ルートを活用すべきとされています。
疾病治療用SaMDに関する二段階承認の考え方において気になる記載は、「一定の有効性が蓋然性をもって確認できる」という箇所です。通知の中では「特定の症状緩和又は状態改善等が探索的治験成績等により示されている」などと説明されていますが、具体的にどの程度のエビデンスであれば「蓋然性がある」と言えるのか?については個別の事例によっても異なることが想定され、今後通知のQAなどで示されるのかもしれません。
また、疾病治療用SaMDについては、二段階目の承認を目指す上でのエビデンス収集方法を計画する上で、一段階目承認時のエビデンスが重要となることから、第1段階承認申請の前からPMDAと相談することも含めて開発戦略を立てることが推奨されています。
SaMD版リバランス通知の課題とこれから
行政と業界団体との意見交換の末に発出されたSaMD版リバランス通知ですが、これがどこまで活用できる制度となるのかについては始まったばかりの制度であるため未知数です。とはいえ、開発における有力な道具が増えたことは開発側にとっては喜ばしいことであり、この制度をどう上手く使っていくか積極的に戦略を練っていくことが重要でしょう。
一方で、SaMDの開発促進を俯瞰的に考える上で、承認制度のあり方は主軸の1つであるものの、もう一つの保険上の評価のあり方議論の目処がつかない限り、開発企業にとってこの制度を活用することのメリットがどの程度あるのかという判断がまだ難しい部分もあります。
開発した製品が診療報酬上十分に評価されるのかという問題はSaMDに限らずではあるものの、SaMDの開発促進に向けた主要な論点として、SaMDの診療報酬上の評価のあり方も並行して議論が進んでいます。11月17日の保材専において、二段階承認の活用において一段階目の承認時は保険外併用療養の活用で議論の方向性が固まりそうですが、この点についても別の機会に記事にまとめられればと思います。
参考資料
- 厚生労働省:プログラム医療機器の特性を踏まえた適切かつ迅速な承認及び開発のためのガイダンス
- 厚生労働省:DASH for SaMD2
- 厚生労働省:プログラム医療機器の特性を踏まえた二段階承認に係る取扱いについて(医薬機審発 1116 第2号)
- Digital Health Times:規制改革推進会議で取り上げられた医療機器プログラム(SaMD)の開発促進における課題-前編-
- Digital Health Times:規制改革推進会議で取り上げられた医療機器プログラム(SaMD)の開発促進における課題-後編-
- 厚生労働省:DASH for SaMD(プログラム医療機器実用化促進パッケージ戦略)
- Digital Health Times:規制改革推進に関する答申から振り返るSaMDの議論の変遷(前編)
