毎年6月に内閣府から公表される「高齢社会白書」の令和6年度版が6月21日に公表(1)されました。
高齢化が進み、すべての団塊世代が75歳以上の後期高齢者になる「2025年問題」が迫っている中、労働人口の減少による社会保障費の増大や、医療、介護不足などが懸念されています。また、労働人口の減少のみならず、労働世代が親の介護に直面することになり、仕事と介護の両立問題についても関心が高まっています。
そこで、株式会社MICIN(本社:東京都千代田区、代表取締役:原聖吾、以下MICIN)では、働きながら親や尊属(自分より上の世代の血族)の介護を行っている方を対象に、介護による仕事への影響の有無や、介護でのオンライン診療の利用に関する意識調査を、インターネットで実施しました。(2)
続きを読む
『医療分野のセキュリティニュース総まとめ 2022』の記事を公開してから時間が経ち、年末年始に執筆を予定していたにもかかわらず、あっという間に5月になってしまいました。
今回は、2023年の1年間と2024年第一四半期において、日本国内の医療分野で発生したセキュリティインシデント事例を振り返り、その傾向を分析してご紹介します。2022年のランサムウェアやEmotetの感染が目立った傾向から、新たに台頭した脅威とそれに対する対策について解説します。医療業界で働く皆様には、本記事が組織のセキュリティ対策を見直すきっかけとなれば幸いです。
続きを読む
2024年2月21日から2月23日にロサンゼルス ハリウッドで開催されたDTx WEST 2024(1)。MICINメンバーが参加してきましたので、今回の記事ではその簡単なレポートをお届けします。
続きを読む
前編では、オンライン診療の受診が可能な場所に関する規制緩和の方向性について紹介しました。後編の記事では、診療報酬に関連する事項についての議論の方向性についてまとめます。
続きを読む
前回の記事(前編(1)後編(2))では、11月20日に開催された規制改革推進会議でオンライン診療が議論されたことについて紹介しました。11月20日の議論で未消化となっていた部分について、改めて2023年12月18日に開催された健康・医療・介護WG(3)での議論がされています。この会議での議論を踏まえつつ、12月26日に公開された規制改革推進に関する中間答申(4)からオンライン診療に関する今年の規制緩和の方向性について取り上げていきます。
続きを読む
前編(1)では、オンライン診療を実施可能な「場所」に関して行われた議論についてまとめましたが、11月20日開催の規制改革推進会議では、オンライン診療における診療報酬上のギャップに関する評価見直しに関する議論が後半に繰り広げられています。後編の記事ではオンライン診療の診療報酬上の見直しに関する要望や意見について取り上げます。
続きを読む
例年よりもやや遅めのスタートではありますが、規制改革推進会議(1)が11月から本格的にスタートしました。同会議ではテーマごとに作業部会を設けて関係省庁や有識者の参加のもと改革案を作ります。医療分野においては健康・医療・介護WG(2)が主たる議論の場であり、11月20日に開催された会合(3)では、Digital Health Timesでも継続的に取り上げてきたオンライン診療が議題として取り上げました。
今回の記事では、11月20日の議論における方向性について前後編で取り上げます。
続きを読む
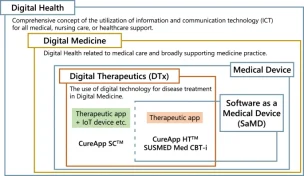
2023年夏から秋にかけて、SaMDに関する制度設計に向けていくつもの動きがみられています。5月に「プログラム医療機器の特性を踏まえた適切かつ迅速な承認及び開発のためのガイダンス」(以下、SaMD開発ガイダンス)(1)が公表され、9月にはDASH for SaMD2(2)が示されました。また、令和6年診療報酬改訂の議論の中で、診療報酬におけるSaMDの扱いについても議論が進められています。
今回の記事では、5月に公表されたSaMD開発ガイダンスとそのガイダンスの内容を踏まえて、新たに11月16日に発出された「プログラム医療機器の特性を踏まえた二段階承認に係る取扱いについて(医薬機審発 1116 第2号)」(以下、SaMD版リバランス通知)(3)について取り上げます。
続きを読む
前回の記事(1)では、2022年10月に開催された「規制改革推進会議第1回医療・介護・感染症対策ワーキング・グループ」で各業界団体が述べたSaMDに関する規制改革要望についてまとめました。
今回の記事では、2022年12月に公表された中間答申(2)、そして2023年6月に公表された最終答申(3)の相違点を比較しつつ、SaMDについて現在進んでいる検討や政府の対応についてみてみたいと思います。
続きを読む
2023年6月1日、内閣府規制改革推進会議は「令和5年度規制改革に関する最終答申」(1)を公表し、この最終答申に基づき、同年6月16日に「規制改革実施計画」(2)が閣議決定されました。2022年10月に開催された「規制改革推進会議第1回医療・介護・感染症対策ワーキング・グループ」(3)で業界団体がSaMDに関する規制改革要望を述べて以降、SaMDに関する議論は様々行われてきました。内閣府が公表した規制改革推進に関する答申は、これらの議論の変遷を確認する上で有用な資料といえます。
続きを読む