前回の記事(1)ではDTxについて全般的な内容を取り上げましたが、この1年でデジタル療法(Digital Therapeutics、DTx)を含めたデジタルヘルスに関連する医療機器の制度動向が国内外共に大きく進展を見せています。以前はドイツのデジタルヘルスケア法について取り上げました(2)が、その他の国も今年に入ってから動きを見せており、今回は英国の動向についてご紹介します。

そもそも英国の医療制度とは?
国によって医療制度が異なることはご周知の通りですが、英国の医療制度はしばしば「国営システム」と表現されることもあるように、税を財源とし国民一般がほぼ無料で医療サービスを享受できる制度です。これを支えているのが有名なNHS (National Health Service、国民保険サービス)ですが、NHS Constitution(NHS憲章)(3) に基づいて運営されています。憲章の詳細については割愛しますが、7つの主要原則が定められており、公的資金を運用する機関として、患者を中心とした医療を限られたリソースの中でいかに最大限効果的に提供していくのかというミッションをもとに策定されています。NHSについては無料で医療が提供されるという良い面もある一方、受診可能な医療機関が各市民で固定されておりフリーアクセスではないことや、受診までに数日〜数週間かかることなどがしばしば課題として指摘されていますが、もしご興味があればご一読ください。
英国のデジタルヘルス政策
このように医療に投資される税金をいかに最大限効果的に使っていくかという観点で、英国の医療政策において医療のデジタルトランスフォーメーションは重要視されています。その文脈で、デジタルヘルスをいかにうまく活用していくかということにも着目されており、複数組織が連携して活用推進・開発促進に向けた体制を取っています。
イギリスのデジタルヘルス政策に関わる部門は主に4つあります。それぞれの組織がどのような役割を果たしているかについて大まかにご紹介していきましょう。
- NICE(National Institute for Health and Care Excellence/英国国立医療技術評価機構)
NICE(4)は、様々な治療法に対して「医学的効果(患者にとっての最適選択)」と「経済的コスト」の両面から評価する組織で、デジタルヘルス技術に関してもエビデンスに基づいたガイダンスを作成し公表することをミッションとしています。
- MHRA(Medicines and Healthcare Products Regulatory Agency/医薬品・医療製品規制庁)
MHRA(5) は、医薬品および医療機器の認可および安全性に責務を持つ組織で、日本のPMDAと同じ位置付けとなります。医療機器となるデジタルヘルス製品(SaMDを含む)の薬事規制を担っており、製品の安全性と効能について評価をしています。
- NHS England(National Health Service in England/英国国民保険サービス)
NHS(6) は、NICEから提供されるエビデンスをもとに、デジタルヘルス技術に対する償還の決定を行っています。英国において、NHSとは、イングランド、スコットランド、ウェールズ、北アイルランドにおける4つの医療制度の総称(7)です。なお、デジタルヘルスに関連する全体的な方針はNHS Englandが決定しています。
- NHSx
NHSx(8)は、NHS EnglandとDepartment of Health and Social Care(保健省)の共同組織であり、各地域のNHSや医療機関のDX推進を支援しています。NHSxの中にAI labがあり、医療AI関連の開発促進および導入を支援しています。この中でも、NICE、MHRA、NHSxについてはこの1年の間に様々な動きを見せており、その一部をご紹介したいと思います。
NICEはデジタルヘルスのエビデンス基準に関するフレームワークを公表
NICEはこの9月に、デジタルヘルス製品(Digital Health Technology、以下「DHT」という。)に関して求められるエビデンス基準のフレームワーク(9)を公表しました。なお、DHTはデジタルヘルス全般の製品を指し、医療機器のカテゴリではないものも含まれます。このフレームワークは大きく2つのセクションに分かれており、前半のsection Aで臨床的効果のエビデンス基準について、後半のsection Bで経済効果評価の基準について記載されています。今回の記事ではsection Aについてのみ取り上げます。NICEは、DHTを3階層(Tier A、Tier B、Tier C)にカテゴリ分けしており、それぞれについてNICEがどう対応していくかについて触れています。
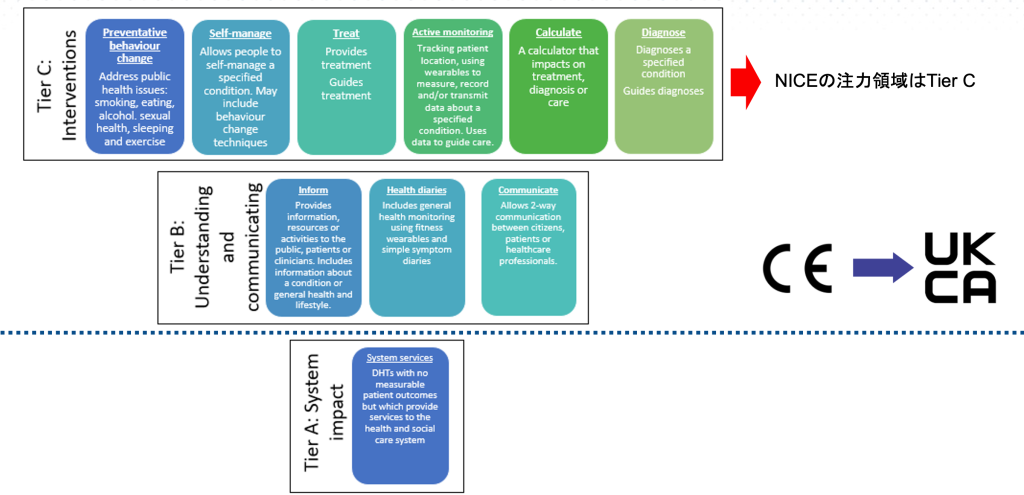
この3つの階層のうち、Tier B及びTier Cが英国では医療機器に該当する製品となり、この2つの階層のDHTはCEマーク取得が必要となります。(なおブレグジットに伴い、2023年7月以降、イングランドではUKCAマークへの切り替えが必要になります。(10))
さらに、Tier CはNICEが今回発表したフレームワークの中でも特に注力すべき領域の製品です。NICEは、この階層は臨床的エビデンスが必要となる製品群と位置付けており、それぞれのカテゴリでどのようなエビデンスが求められるのかを説明しています。例えば、いわゆるDTx製品は、Tier Cの「Treat」に含まれる製品になるかと考えられますが、下の表1のようなエビデンスが必要と公表されています。また、場合によっては海外ではなく英国の医療環境に合わせたエビデンスを収集すべきであるとしています。

MHRAからはAI/SaMDに関する方針発表及び国際連携の強化
MHRAもまた、精力的にこの領域について動きを見せています。2021年9月には規制当局として、他関係組織と連携しながら、「英国がこれまで通り有効性と安全性を評価しながら、医療機器プログラム(SaMD)及び医療機器AI(AIaMD)のイノベーションを促進させていくスタンスである」とする規制当局としての方針(11)を改めて明確に打ち出しており、具体的に表2に記載する11個のWork Package(WP)を発表しています。

余談ですが、プロジェクト名のついたWP 9-11は、もしかしたらMHRAにとっても思い入れのあるWPなのかもしれません。特に最後の「Project Ship of Theseus (「テセウスの船」計画)と名付けられたAI adaptivityに関するWPは、「適応させていったAIは果たして元々のAIと同じものとして扱って良いのか?」というAI適応性の問題を「テセウスの船」と喩えているようで、まさに言い得て妙という感もあり、ウィットに溢れた英国のお国柄が感じられます。
また、AI/ML医療機器の品質保証を目指すGood Machine Learning Practice(GMLP)の策定に向けて、AI/ML医療機器の開発と規制の構築に注力している米国FDAやカナダ保健省と共同声明(12) を2021年10月に発出しています。AI/ML医療機器開発の国際競争は加速化している中で、この共同声明からは、イニシアチブを取ろうとする三国の思惑も見えてきます。
NHSxはAI labを立ち上げ、AI活用推進を支援
NHSxは最近立ち上がった医療DXを担う横串の部門になりますが、その中の注目部署としてAI lab(13)が立ち上がっています。AI labのミッションは「英国の医療・ケアシステムにおいて、安全で倫理的かつ効果的なAI駆動技術の開発と導入を可能にすること」とされています。主な目的は、①ヘルスケア領域におけるAIテクノロジーの可能性を示し、②ヘルスケア領域で活用するAIが医療従事者や社会にとって信用・信頼のおけるものとされ、③またヘルスケア領域のAIが安全で有効であるということを示せるよう規制を発展させていくことの3つであるとしています。
①については「AI Skunkworks」(14) という専門的な小規模チームを編成し、特化して対応にあたっており、②については多様な人種が共存する英国におけるAIの開発や活用において、倫理的な問題を学会や第三者機関と協力しながら課題を検討しているようです。また、③については、MHRAやNICEに規制と評価に関するサポートやガイダンス提供を行うなどの協力体制を取っています。
最後に
AIを含めたIT技術の急速な発展により、デジタルヘルス関連製品のバラエティも加速度的に増してきています。その中で、英国の政府機関は、最新技術の知識を迅速にアップデートしながら、複数組織で緊密に連携して産業促進と柔軟な規制体系構築の検討を始めているようです。この領域は各国しのぎを削っており、産業育成と規制のバランスをとりながら動いています。果たして今後、どの国が先導してこの産業を推し進めていくことになるのでしょうか?
なお、本記事については、9月に英国大使館で開催されたセミナー「日英におけるデジタルヘルス法規制とビジネス創出」での講演をベースに作成しました。記事公開にご承諾いただきました英国大使館ご関係者の皆様、ありがとうございました。本セミナーに関する資料請求・お問い合わせに関しましては、英国大使館 国際通商部 ライフサイエンス担当様までご連絡ください。(連絡先メールアドレス :LS.Japan.trade@fco.gov.u)
参考資料
(1)Digital Health Times:活発になり始めたデジタル療法の国内開発
(2)Digital Health Times:DVGから見えるドイツのデジタルヘルスへの期待
(3)GOV.UK:Guidance “The NHS Constitution for England”
(4)NICE
(5)GOV.UK:Medicines & Healthcare products Regulatory Agency
(6)NHS
(7)INSTITUTE FOR GOVERNMENT:Devolution and the NHS
(8)NHSx
(9)NICE:Evidence standards framework for digital health technologies
(10)GOV.UK:Guidance “Regulating medical devices in the UK”
(11)GOV.UK:Guidance “Software and AI as a Medical Device Change Programme”
(13)NHSx:The NHS AI Lab
(14)NHSx:The AI Lab Skunkworks
