2020年9月7日、デジタルヘルス領域で気になるニュースが入ってきました。2018年に米国で展開開始されたApple Watch ECG appが「Appleの心電図アプリケーション」「Appleの不規則な心拍の通知プログラム」という製品名で、日本でも医療機器として認可(2020年9月4日付)されていたことが公益財団法人医療機器センター(以下、「JAAME」という。)の医療機器承認速報により判明したためです。なお、本件については、JAAMEより公式声明がでていますのでこちらも合わせてご確認ください(1)。
実は、医療機器開発に詳しい人たちの間では、Apple Watch ECG appの国内承認はそろそろなんじゃないか…?と密かに話題になっていました。なぜそのような予測ができたのでしょう?今回は、Apple Watch ECG appの国内承認を糸口として、医療機器プログラムとはどのようなものかをご説明したいと思います。

Apple Watch ECG appの日米ギャップ
2018年9月にApple社が公表したApple Watch Series 4には、心電図測定機能がついているということで国内外で大きな話題となりました。Apple社は米国の医薬食品局(以下、「FDA」という。)からApple Watch ECG appを医療機器として認可を得ており、米国ではApple Watch series4の解禁とともにこのアプリが使用可能となっていました。
一方で、日本でApple Watch Series 4の販売が始まった時、国内展開されるApple Watch series4からはApple Watch ECG appの機能が取り除かれていました。理由は、「心電図測定」「脈の不整通知」という機能が医療機器に該当するため、国内での医療機器として認可を得る必要があり、当時その過程をApple社が取っていなかったためです。
その結果、多くのAppleファンが早く使いたいと待ち望みながらも、国内では使えない状況がこの2年続いていました。
Apple Watch ECG appは医療機器なのか?
そもそも、Apple Watch ECG appが医療機器になるとはどういうことなのでしょうか?2007年にiPhoneが、そして2008年にApp storeが世の中に登場したことを皮切りに、ヘルスケア分野においてスマートフォンを活用しようという流れが世界的に加速しました。その中で、ソフトウェア単体でもその使用方法によっては医療機器に該当するものも出てくるのではないか?ということから、医療機器規制の国際整合化を議論するフォーラムであるInternational Medical Device Regulators Forum(以下、「IMDRF」という。)で規制に関する議論が始まり、「Software as a Medical Device」(以下、「SaMD」という。)が定義され、医療機器として有効性及び安全性を評価していこうという流れになりました。SaMDはIMDRFにより以下のように定義されています(2)。
The term “Software as a Medical Device” (SaMD) is defined as software intended to be used for one or more medical purposes that perform these purposes without being part of a hardware medical device.
– SaMDとは、1つもしくは複数の医療目的で用いられるソフトウェアであり、ハードウェア医療機器の1部品として作動することを目的としているものではないものを指す。
IMDRF:Software as a Medical Device (SaMD)
この流れと並行して、2014年、日本でも薬事法から薬機法に改正された際、医療機器の「定義」に当てはまるプログラムは医療機器として規制の対象となることが定められました。
さて、ここでいう医療機器の「定義」とはなんでしょうか。医療機器は、
「人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等(再生医療等製品を除く。)であって、政令で定めるものをいう。」
薬機法第2条第4項
と法的に定義されています。この条文の「政令で定めるもの」の中に「プログラム」というカテゴリが作られており、これが「医療機器プログラム」(=SaMD)と言われるものになります。SaMDはさらに、1. 疾病診断用プログラム、2. 疾病治療用プログラム、3. 疾病予防用プログラムの3つに類別されます。
薬機法は大まかに言えば、医療製品の流通規制に関する法律です。つまり薬機法で「医療機器と定義されるもの」は自由に作ったり、流通させたりすることができません。医療機器プログラムに該当するかしないか、というのは、プログラムを開発する上で大変重要なポイントとなります。
なお、ここでいう「流通」とは「電気通信回線を通じて提供すること」も含まれており、有償か無償かを問いません。例えば、アカデミア研究者が開発したプログラムを善意で無償公開した場合、それがSaMDに該当するものであれば薬機法違反となってしまいます。(実はその疑いがあるとして当局から指摘された事例は以前生じています。)
このような法律の背景から、心電図機能を標榜するApple Watch ECG appは、日本においても規制対象となる「医療機器プログラム」であり、認可なく流通させることができなかったのです。
SaMDの該当性とクラス分類は難しい!
薬機法上の定義に当てはまればプログラムも医療機器になるとはいえ、その「定義に当てはまるかどうか」の判断が難しく、開発者の頭を悩ませているという話はよく耳にします。厚労省からは、該当性に関する通知やQ&A(3)が発出されていますので、こちらを参考にするのがまずは入り口としてよいでしょう。
また、医療機器は、その製品の持つリスクに応じて4つにクラス分類されるのですが、医療機器プログラムの場合、クラスIに相当するものは、医療機器の定義に当てはまっても規制の対象にはならないというルールがさらに該当性の問題を複雑にしているというところもあります。(表1)

SaMDの該当性問題については、今後、別の記事で詳しく紹介する機会を設けたいと思いますが、ヘルスケア領域のプログラムを開発される方は、該当性について十分に注意して開発する必要があります。該当性の判断が難しい場合は、都道府県薬務課が該当性判断の管轄部署になるため、早めにご相談にいくのがよいでしょう。
さて、医療機器にクラス分類が設けられている理由は、リスクに応じて規制方法を変えているためです。表1のとおり、最もリスクの低いクラスIの製品については自己認証での「届出」という形で規制されます。一方で、最もリスクの高いクラスIVについては、医薬品医療機器総合機構(以下、「PMDA」という。)での厳密な審査を経て、厚労大臣の「承認」が必要になります。
クラスII/IIIについては少し複雑で、このクラスの製品については、すでに多く流通しているカテゴリの医療機器も多く、そのような医療機器の場合は国が「認証基準」を設けています。認証基準に則って評価可能な医療機器については第三者認証機関(4)と呼ばれる国に登録された民間機関が「認証」します。一方で認証基準では評価できない医療機器については、クラスIV製品と同様にPMDAでの承認審査を経て「承認」が必要になります。
SaMDの場合、クラスIはルール上存在しませんし、また性質上おそらくクラスIV相当のものは存在しえないでしょう。よって現存するもしくは今後開発されるSaMDはクラスIIもしくはクラスIIIということになります。認証基準があるSaMDは第三者認証機関による認証審査、認証基準がない場合はPMDAが承認審査を行うことで認可されます。
さて、Apple Watch ECG appはどうだったかというと、PMDAの審査を経て承認されています。つまりこれまでに認証基準のない医療機器と判断されたということになります。
医療機器の一般的名称とは?
最初にお話した通り、Apple Watch ECG appがそろそろ国内展開されるのではないか、という話は医療機器開発に携わる人達の間で少し話題になっていました。1つには、Apple社が5月に医療機器外国製造業者認定を取得していたこと、そしてもう1つは7月末にApple Watch ECG appに関連していると思われる「一般的名称」が厚労省により新設されたことが理由です。
1つ目の外国製造業者認定取得については、外国製造の医療機器を日本で輸入販売や海外で設計・製造する場合、製造所を登録する必要があり、Apple社がApple Watch ECGを日本に展開する上で必要な手続きでした。この情報を持って、「あ、Apple社は何か医療機器に相当するものを日本で展開しようとしているのだな」と目されていました(5)。
そして、2つ目の一般的名称についてですが、医療機器は上記のクラス分類を更に細かく医療機器のタイプに応じて細かく「一般的名称」というものにカテゴライズしており、上記の認証基準もこれに紐付いています。これまでに認可されているSaMDの一部例を表2にお示しします。(なお、CureApp SCニコチン依存治療アプリについては、厳密にはSaMDではないのですが、概念の近い製品として表に記載しています。)

例えばですが、アルム社の汎用画像診断装置用プログラムJoin(認証番号 227AOBZX00007000)は、クラスIIに該当する疾病診断用プログラムで一般的名称は「汎用画像診断装置ワークステーション用プログラム」になります(6)。「汎用画像診断装置ワークステーション用プログラム」には認証基準があるため、第三者認証機関での認可が必要になります。
一方で、エルピクセル社の医用画像解析ソフトウェア EIRL aneurysm(承認番号 30100BZX00142000)も同じくクラスIIに該当する疾病診断用プログラムで、一般的名称は「MR 装置ワークステーション用プログラム」です(7)。こちらも認証基準はあるのですが、この製品の場合は認証基準では評価しきれない機能を持つ製品であるということで、PMDAでの審査が必要になります。(これを認証基準外れ、認証外れ、ということもあります。)
このように既存の一般的名称がある場合はそれが使われるのですが、新しい医療機器によっては該当する一般的名称がないことも少なからずあります。その場合は、厚生労働省で一般的名称が新設されることになります。
さて、7月20日、厚生労働省から「家庭用心電計プログラム」「家庭用心拍数モニタプログラム」という一般的名称が新設されたと公表されました(8)。一般的名称の新設は承認審査の中で必要に応じて行われるものですので、これらの一般的名称に該当するSaMDがPMDAで承認審査中なのだとここからわかります。
Apple社の外国製造業者認定取得の動きとあわせて、おそらくこれはApple Watch ECGの一般的名称であり、PMDAで承認審査が進んでいるのではないか、と7月時点で業界の中では予測されていたのです。
Apple Watch ECG appの一般的名称からわかること
さて、便宜的にApple Watch ECG appとこの記事の中では呼んできましたが、正しくは「Appleの心電図アプリケーション(承認番号30200BZI00020000)」「Appleの不規則な心拍の通知プログラム(承認番号30200BZI00021000)」というのが製品販売名になります。それぞれの一般的名称は、「家庭用心電計プログラム」「家庭用心拍数モニタプログラム」です。
一般的名称はPMDAのホームページ(9)でそれぞれどのようなものかが公表されています。それぞれの一般的名称の中身を見てみましょう。


ここで注目したい点は、どちらの一般的名称もその定義説明が「汎用機器から得られた情報を用いて」で始まっていることです。これまでのSaMDは、医療機器で得られた情報を用いて何某かの解析を行いアウトプットを提示するものばかりだったのです。例えば、表2で提示したEndoBrainの一般的名称「疾患鑑別用内視鏡画像診断支援プログラム」だとこちらのように「内視鏡画像から得られた情報」を用いるとあります。
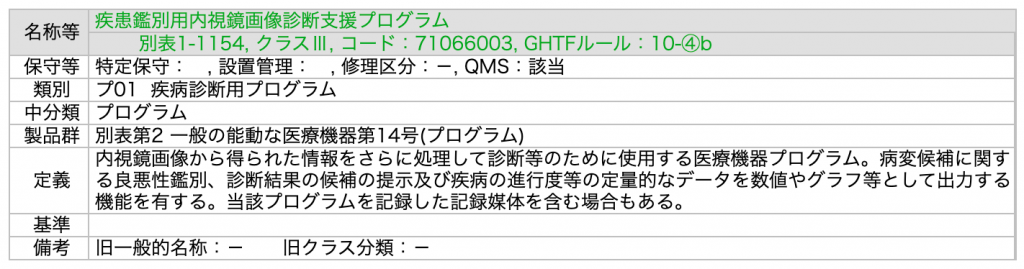
Apple Watch ECG appの出現は、「汎用機器」により取得されたインプットデータを用いても、アウトプット次第では医療機器になるものが出てきたということを意味しています。
つまり、データを取るApple Watch本体は医療機器ではないけれど、解析して結果を提示するApple Watch ECG appは医療機器、という状況が生まれているのです。この状況からは、Apple Watchに限らず、医療機器ではないデバイス、例えばスマートフォンやスマートスピーカといったもののカメラ機能、音声認識機能を用いたSaMDが今後国内でも開発されるだろうという未来が広がっているように思われます。
なお、蛇足であるのですが、一般的名称にもあるとおり、Apple Watch ECG appは「家庭用」医療機器です。医師が診断に用いることを想定した製品ではありませんので、ご留意ください。
最後に
Apple Watch ECG appの国内承認をきっかけに、SaMDに興味を持たれた方も多いのではないでしょうか。Apple Watchがどのような情報を持って審査されたのか、規制当局からどのような評価を受けたのか、など、筆者も書きたいことが盛りだくさんで不完全燃焼気味です。
Digital Health Timesでは、今後もSaMDに関する情報をわかりやすく記事にしていきたいと思います。
注釈
(1) 公益財団法人医療機器センター:「医療機器承認速報」に掲載された 「家庭用心電計プログラム」及び「家庭用心拍数モニタプログラム」の 承認取得情報に関する適切な取扱いのお願い
(2)IMDRF:Software as a Medical Device (SaMD)
(3) 公益財団法人医療機器センター:医薬品医療機器等法における医療機器プログラムの取り扱い
(4)厚生労働省:登録認証機関制度について
(5)日経クロステック:「Apple Watch」心電図機能の日本解禁は近い?、「外国製造業者登録」の次の壁
(6)添付文書:汎用画像診断装置用プログラムJoin
(7)添付文書:医用画像解析ソフトウェア EIRL aneurysm
(8) PMDA:一般的名称の追加について (厚生労働省告示第267号:令和2年7月20日 薬生発0720第1号:令和2年7月20日)
(9) PMDA:医療機器基準関連情報
(2020/9/12 16:00 誤字、表現を一部修正しました。)
